Drei Fraunhofer-Institute haben gemeinsam ein fälschungssicheres Barcodesystem entwickelt, mit dem die Echtheit von Medikamenten per Smartphone überprüft werden kann, ohne auf eine Datenbank zurückzugreifen. Das System lässt sich aber auch in anderen Branchen einsetzen.
ANZEIGE
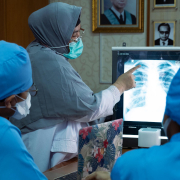
Am Herz- und Diabeteszentrum NRW wurde erstmals einem Patienten in Europa eine biologische Mitralklappenprothese eingesetzt, die länger halten soll als bisherige künstliche Herzklappen. Die biologische Herzklappe besteht aus einem neuartigen, sogenannten Resilia-Rinderperikardgewebe, das im Tierversuch Kalzifizierungs- und Degenerationsprozesse besser aufhalten konnte als bisher verwendetes Gewebe.
Die RAYDIAX GmbH konnte sich eine Finanzierung in Höhe von 3,5 Mio. Euro sichern. Das Geld kommt vom High-Tech Gründerfonds, bmp Ventures und Business Angels. Außerdem erhält Raydiax eine Förderung des Bundeswirtschaftsministeriums.
Die Stadt Wien, die Wirtschaftskammer Wien und die Allgemeine Unfallversicherungsanstalt (AUVA) haben vereinbart, am Standort Wien-Brigittenau einen modernen Forschungs- und Wirtschaftscampus zu errichten. Das gemeinsame Ziel: die nachhaltige Vernetzung von Gesundheit, Forschung und Wirtschaft.
Forscher am Fraunhofer-Institut für Zuverlässigkeit und Mikrointegration IZM in Berlin haben gemeinsam mit 30 europäischen Partnern aus Industrie und Forschung im Rahmen des ESCEL-Projekts APPLAUSE einen flexibles, kabelloses Messgerät entwickelt, mit dem die Herzfunktion von Patienten überwacht werden kann. Es sieht aus wie ein Pflaster und soll die Zahl der stationären Untersuchungen für Risikopatienten reduzieren.
Das Leipziger Unternehmen VivoSensMedical sowie die Krankenkassen BIG direkt gesund und HEK – Hanseatische Krankenkasse haben ihre Kooperationen erneuert. Für Frauen, die dort versichert sind, übernehmen die Krankenkassen auch weiterhin die Diagnostik mit OvulaRing als zusätzliche Leistung. Dazu gehört nun auch, die Übernahme des bisherigen Eigenanteils. Das Medizinprodukt unterstützt Frauen mit Kinderwunsch bei der Zyklusdiagnostik.
Auf dem Weltgesundheitsgipfel Mitte Oktober in Berlin haben Siemens Healthineers und der Globale Fonds zur Bekämpfung von AIDS, Tuberkulose und Malaria (Globaler Fonds) eine Partnerschaft für den beschleunigten Einsatz von künstlicher Intelligenz (KI) bei der Diagnostik von Tuberkulose (TB) bekannt gegeben.
Für das Programm der microTEC Südwest Clusterkonferenz am 16. und 17. April 2024 im Konzerthaus Freiburg werden Vorträge mit Praxisbezug gesucht. Bis zum 27. Oktober ist es noch möglich, online Themenvorschläge einzureichen.
Kinder-und Familiengesundheit stehen in diesem Jahr im Mittelpunkt des Wittener Preises für Gesundheitsvisionäre. Bewerber, die an digitalen Lösungen in diesem Bereich arbeiten, können noch bis zum 3. November teilnehmen. Sechs von ihnen präsentieren ihre Ideen am 16. November vor einer hochkarätigen Jury. Den Gewinnern winken insgesamt 10.000 Euro Preisgeld.
Die sächsische SmartNanotubes Technologies GmbH und die dänische Micro Technic A/S entwickeln gemeinsam einen intelligenten Geruchssensor, der ab Mitte 2024 in der Pflege von Inkontinenzpatienten eingesetzt werden soll. Mit Hilfe der Technologie sollen Wundkrankheiten bei den Betroffenen verhindert werden, das Pflegepersonal schnell eingreifen kann.

 Fraunhofer IAP/Nadine Sandowski
Fraunhofer IAP/Nadine Sandowski Foto: Sönke Stute-Schlamme, HDZ NRW
Foto: Sönke Stute-Schlamme, HDZ NRW




 vegefox.com - stock.adobe.com
vegefox.com - stock.adobe.com NanoTubesTechnologies GmbH
NanoTubesTechnologies GmbH